Quimioprevención en la Enfermedad Inflamatoria Intestinal
Dr. Jesús Kazuo Yamamoto Furusho
Fundador y director de la Clínica de Enfermedad Inflamatoria Intestinal, Departamento de Gastroenterología del Instituto Nacional de Ciencias Médicas y Nutrición.
¿Qué es la quimioprevención?
En general, la quimioprevención permite reducir las probabilidades de tener un cáncer en los grupos de la población que, por susceptibilidad genética innata, por enfermedades que incrementan el riesgo de cáncer u otros factores conocidos, tienen un riesgo mayor de desarrollar lesiones malignas.
Quimioprevención y 5-AMINOSALICILATOS
Desde hace varias décadas, la sulfasalazina se ha utilizado en el tratamiento de la Enfermedad Inflamatoria Intestinal (EII), tanto para la inducción de la remisión de las recaídas como para el tratamiento de mantenimiento de la misma.
En el intestino, la sulfasalazina se desdobla en sulfapiridina, que tiene propiedades bacteriostáticas, y en ácido 5-aminosalicílico (5-ASA), que tiene propiedades antiinflamatorias.
No se conoce con exactitud el mecanismo por el que este fármaco produce un efecto protector en la carcinogenia, probablemente pueda deberse a su efecto antiinflamatorio y por la inhibición de las PG. La administración de 5-ASA en pacientes con EII disminuye la proliferación epitelial en el recto y aumenta la tasa de apoptosis. Esta mayor tasa de apoptosis puede deberse a la inducción de la actividad de la caspasa–3 que produce la mesalazina.1,2 El uso de mesalazina ha mostrado una disminución del riesgo de CCR del 81%, este efecto es independiente de la dosis. Estudios han demostrado que la mesalazina induce la apoptosis de forma selectiva en células neoplásicas, además de que inhibe la acción de COX-2 y NF-kB. En cambio, el uso de sulfasalazina por sí sola no muestra una reducción en el riesgo de presentar cáncer colorrectal (CCR) en la misma magnitud que la mesalazina debido a su efecto adverso en la absorción de ácido fólico, sin embargo, la suplementación con ácido fólico en estos pacientes muestra una disminución del CCR del 62%.3
¿Hay suficiente evidencia?
No hay estudios prospectivos y aleatorizados que demuestren un efecto protector de los salicilatos en el CCR en pacientes con EII. Hay estudios epidemiológicos de casos y controles o de cohortes que demuestran este efecto protector. En uno de los primeros estudios epidemiológicos publicados por Pinczowski -et al.4, los autores demostraron que en pacientes con colitis ulcerosa crónica idiopática (CUCI) el tratamiento con sulfasalazina durante por lo menos 3 meses se asociaba a un efecto protector significativo en el CCR. El cumplimiento correcto del tratamiento con sulfasalazina igualmente reduce el riesgo de CCR.5
En un estudio de casos y controles en pacientes con CUCI, que seguían tratamiento de mantenimiento durante 5-10 años con algún compuesto de 5-ASA, se demostró que globalmente el uso del fármaco produjo un efecto protector, y redujo en un 75% el riesgo de CCR (intervalo de confianza [IC] 95%: 0,13-0,48). De todos los compuestos de 5-ASA, la mesalazina fue la que consiguió un grado mayor de protección. El mayor efecto protector derivado del tratamiento con 5-ASA se alcanzó con una reducción del riesgo de CCR del 81% (razón de momios [RM]= 0,09; IC 95%: 0,03-0,28). En este mismo trabajo, se identificó como factor protector, el grupo de pacientes que realizaban controles médicos regulares.6
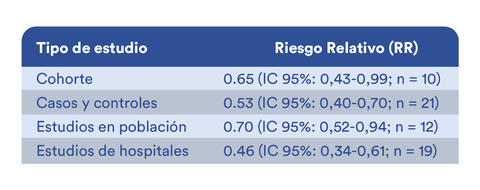
Finalmente, en una revisión sistemática con meta-análisis7 se concluye el papel protector del uso de 5-ASA en la protección de cáncer colorrectal (riesgo relativo [RR]= 0,57, IC 95%: 0,45-0,71) lo cual fue confirmado al analizar por diseño del estudio y tipo de población tal como se demuestra a continuación:
Quimioprevención y esteorides
Los esteroides son fármacos ampliamente utilizados en el tratamiento de la EII; a pesar de ello, no hay estudios controlados que hayan evaluado el efecto protector contra el CCR. -Eaden et al-.6 , en un estudio de casos y controles, demostraron que la administración de esteroides por vía sistémica produce una reducción significativa del riesgo de experimentar un CCR (OR= 0,26; IC del 95%, 0,01-0,70), en el estudio no se especificaba la duración del tratamiento. Los esteroides podrían tener un efecto quimiopreventivo en el CCR, pero los efectos adversos con su uso prolongado no permiten considerarlo como un fármaco seguro para la quimioprevención.
Quimioprevención e inmunomoduladores

Hay distintos trabajos que han evaluado el efecto quimiopreventivo en la displasia o el CCR de los fármacos inmunomoduladores más utilizados en la EII (6-mercaptopurina; azatioprina; metotrexato; ciclosporina). Ninguno de ellos ha demostrado tener un efecto protector, aunque tampoco se ha demostrado que incremente el riesgo de transformación neoplásica de la mucosa colónica.8,9
Quimioprevención y ácido ursodeoxicólico (AUDC)
Aproximadamente, el 2-4% de los pacientes con CUCI tienen una colangitis esclerosante primaria (CEP). La asociación de las 2 enfermedades incrementa el riesgo de CCR en un 50% a los 25 años de la enfermedad del colon.
El ácido desoxicólico podría estar implicado en la carcinogenia del CCR, ya que se encuentra incrementado en pacientes con CEP, y una situación similar se produce en los pacientes con CUCI y CCR que tienen valores de ácidos biliares en heces superiores que en los casos con CUCI sin CCR.9 Si bien no se ha demostrado en humanos, estudios experimentales han demostrado que el AUDC inhibe la carcinogenia. Se indican distintos mecanismos para explicar el efecto anticarcinogénico del AUDC:
a) La disminución del ácido desoxicólico en el colon.
b) El bloqueo de la vía del ciclo de regulación celular que puede estar alterada en los casos de CUCI con CCR.
c) Por un efecto antioxidante que produce una estabilización de la membrana mitocondrial.
Hay 2 estudios prospectivos, aleatorizados y controlados que demuestran el efecto beneficioso del ácido ursodeoxicólico. En el primero, realizado en 59 pacientes con CUCI y CEP, se demostró que el uso de ácido ursodeoxicólico disminuyó el riesgo de desarrollar displasia o neoplasia avanzada (OR = 0,18; IC del 95%, 0,05-0,61; p= 0,005). Se trata de un estudio con limitaciones, por el número reducido de casos, no fue diseñado con intención de aleatorización, no se comprobó el cumplimiento del tratamiento, y el efecto protector no se correlacionó con la dosis administrada, ni con la duración del tratamiento.10 En el segundo ensayo, realizado en 52 pacientes con CUCI y CEP, se demostró un riesgo relativo de 0,26 (IC del 95%, 0,06-0,92) de displasia y CCR en el grupo que se trató con ácido ursodeoxicólico.11
Quimioprevención y folatos

Estudios epidemiológicos han demostrado que el déficit de folatos puede ser un factor de riesgo de neoplasias y que los suplementos de folatos disminuyen el riesgo de CCR. En la CUCI es frecuente la asociación de déficit de ácido fólico por ingesta nutricional inadecuada e incremento de pérdidas intestinales, coincidiendo con la actividad inflamatoria.12
El aumento de proliferación de la mucosa colónica es una alteración inicial del CCR.
En un único trabajo prospectivo y aleatorizado, realizado en 24 pacientes con CUCI, se demostró que el aporte de 15 mg/día de ácido fólico durante 3 meses disminuyó en un 40% la proliferación celular respecto al grupo que tomó placebo.10 Dos trabajos epidemiológicos retrospectivos apuntan a un posible efecto protector del ácido fólico en el riesgo de displasias.13-15
Conclusión
Los datos existentes sobre la quimioprevención del CCR en pacientes con EII no son del todo sólidos, ya que hay escasos trabajos controlados. También hay que destacar que la mayoría de los trabajos se han realizado en pacientes con CUCI y muy pocos en pacientes con Enfermedad de Crohn de colon. Podemos concluir que hay datos epidemiológicos que indican que el uso de 5-ASA disminuye el riesgo de displasia y CCR. Además, no debe olvidarse que este fármaco tiene un efecto directo en la CUCI, con la disminución de las recaídas y tiene un buen perfil de seguridad. En pacientes con CUCI y CEP asociada puede recomendarse el uso de ácido ursodeoxicólico, y el suplemento de folatos en la CUCI también parece tener un efecto protector, ya que es un fármaco seguro y de bajo coste. Sería deseable disponer de más estudios controlados para poder confirmar con mayor seguridad estas recomendaciones, así como el hecho de valorar el efecto de otros fármacos, como son los inmunomodulares.
1. Reinacher-Schick A, Seidensticher F, Petrasch S, Reiser M, Philippou S, Theegarten D, et al. Mesalazine changes apoptosis and proliferation in normal mucosa of patients with sporadic polyps of the large bowel. Endoscopy. 2000;32:245-54.
2. Reinacher-Schick A, Schoeneck A, Graeven U, Schwarte-Waldhoff I, Schmiegel W. Mesalazine causes a mitotic arrest and induces caspase-dependent apoptosis in colon carcinoma cells. Carcinogenesis. 2003;24:443-51.
3. Lashner BA, Heidenreich PA, Su GL, Kane SV, Hanauer SB. Effect of folate supplementation on the incidence of dysplasia and cancer in chronic ulcerative colitis: A case-control study. Gastroenterology 1989; 97: 255–259.
4. Pinczowski D, Ekbom A, Baron J, Yuen J, Adami HO. Risk factors for colorectal cancer in patients with ulcerative colitis: a case-control study. Gastroenterology. 1994;107:117-20.
5. Moody GA, Jayanthi V, Probert CS, Mac Kay H, Mayberry JF. Long-term therapy with sulphasalazine protects against colorectal cancer in ulcerative colitis: a retrospective study of colorectal cancer risk and compliance with treatment in Leicestershire. Eur J Gastroenterol Hepatol. 1996;8:1179-83.
6. Eaden J, Abrams K, Ekbom A, Jackson E, Mayberry JF. Colorectal cancer prevention in ulcerative colitis: a case-control study. Aliment Pharmacol Ther. 2000;14:145-53.
7. Bonovas S, Fiorino G, Lytras T, Nikolopoulos G, Peyrin-Biroulet L, Danese S. Systematic review with meta-analysis: use of 5-aminosalicylates and risk of colorectal neoplasia in patients with inflammatory bowel disease. Aliment Pharmacol Ther. 2017; 45: 1179-1192.
8. Matula S, Croog V, Itzkowitz S, Harpaz N, Bodian C, Hossain S, et al. Chemo prevention of colorectal neoplasia in ulcerative colitis: the effect of 6-mercaptopurine. Clin Gastroenterol Hepatol. 2005;3: 1015-21.
9. Hill MJ, Melville DM, Lennard-Jones JE, Neale K, Ritchie JK. Faecal bile acids, dysplasia, and carcinoma in ulcerative colitis. Lancet. 1987;2:185-6.
10. Tung BY, Emond MJ, Haggitt RC, Bronner MP, Kimmey MB, Kowdley KV, et al. Ursodiol use is associated with lower prevalence of colonic neoplasia in patients with ulcerative colitis and primary sclerosing cholangitis. Ann Intern Med. 2001;134:89-95.
11. Pardis DS, Loftus EV, Kremers L, Keach J, Lindor KD. Ursodeoxycholic acid as a chemopreventive agent in patients with ulcerative colitis and primary sclerosing cholangitis. Gastroenterology. 2003;124:889-93.
12. Freudenheim JL, Graham S, Marshall JR, Haughey BP, Cholewinski S, Wilkinson G. Folate intake and carcinogenesis of the colon and rectum. Int J Epidemiol. 1991;20:368-74.
13. Biasco G, Zannoni U, Paganelli GM, Santucci R, Gionchetti P, Rivolta G, et al. Folic acid supplementation and cell kinetics of rectal mucosa in patients with ulcerative colitis. Cancer Epidemiol. Biomarkers Prev. 1997;6:469-71.
14. Lashner BA, Heidenreich PA, Su GL, Kane SV, Hanauer SB. Effect of folate supplementation on the incidence of dysplasia and cancer in chronic ulcerative colitis. A case-control study. Gastroenterology. 1989;97:255-9.
15. Lashner BA, Provencher KS, Seidner DL, Knesebeck A, Brzezinski A. The effect of folic acid supplementation on the risk for cancer or dysplasia in ulcerative colitis. Gastroenterology. 1997;112:29-32.