Actualidades en Enfermedad Inflamatoria Intestinal
Dr. Arturo Mayoral Zavala
Clínica de Intestino, Departamento de Gastroenterología.
UMAE Hospital de Especialidades Dr. Bernardo Sepúlveda Gutiérrez.
Centro Médico Nacional Siglo XXI, IMSS, Ciudad de México.
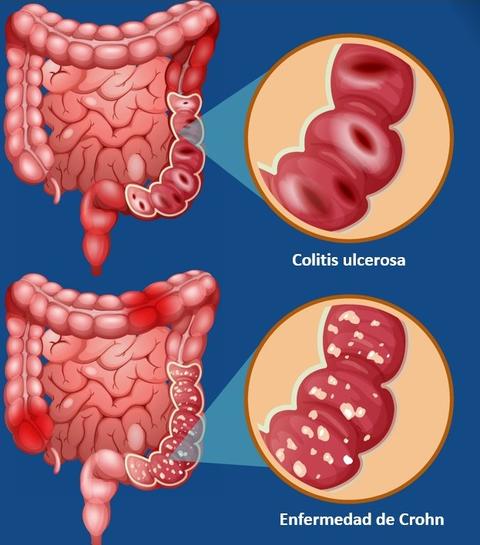
La Enfermedad Inflamatoria Intestinal (EII) comprende la Colitis Ulcerosa (CU), la Enfermedad de Crohn (EC) y la Colitis Indeterminada;
El objetivo inicial de tratamiento de la EII fue obtener la remisión clínica, sin embargo, esto ha cambiado con el avance en métodos para evaluar la actividad de la EII y los tratamientos. Estudios recientes muestran que el objetivo de tratamiento de la EII es obtener la curación de la mucosa, con lo que se reduce el rango de hospitalización y resección intestina y se mejora el pronóstico.
Disminuir el rango de monitorización con colonoscopia en pacientes con EII incrementa el riesgo de complicaciones relacionadas con la enfermedad, habiendo reportado los pacientes mayor vergüenza y carga de limpieza intestinal para la colonoscopia e incremento del dolor durante la colonoscopia. Menores colonoscopias pueden prevenir infecciones como la enfermedad por coronavirus que inició en 2019, transmitiéndose por endoscopia. Esto hace necesario identificar un biomarcador confiable, no invasivo para reducir la carga y costo del paciente. Un biomarcador es una observación biológica que predice un punto final clínicamente relevante o un resultado intermedio en lugar de un resultado que es más difícil de observar.
Biton et al reportaron que altos niveles de PCR fue un predictor de recaída por medición de PCR cada 3 meses en pacientes con EC.
Objetivos de tratamiento para EII
La curación mucosa es uno de los mayores objetivos terapéuticos específicos. El sub-score endoscópico de Mayo (MES) 0, está asociado con resultados superiores de la enfermedad, mientras que la curación endoscópica en CU es comúnmente definida como <1. En la EC se recomienda que la curación endoscópica se defina como un score endoscópico simple para la EC (SES-CD) <3 o ausencia de ulceración mientras que hay ausencia para definir remisión endoscópica. Tratar de acuerdo con un objetivo (T2T) se ha propuesto como estrategia terapéutica con el objetivo de mejorar el pronóstico a largo plazo en enfermedades crónicas. La endoscopia actualmente es el estándar de oro para monitorizar la curación mucosa en pacientes con EII.
El recientemente actualizado STRIDE-II (Selecting Therapeutic Targets in Inflammatory Bowel Disease) establece que los objetivos más importantes de tratamiento a largo plazo son la remisión clínica, la curación endoscópica, la recuperación de la calidad de vida y la ausencia de discapacidad.
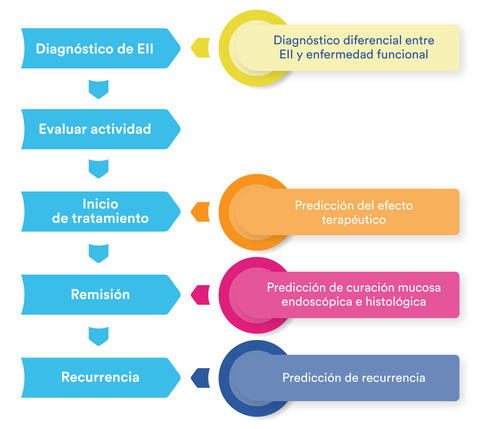
Papel de los biomarcadores en el diagnóstico y tratamiento de la EII
En el área de la EII se ha usado para diferenciar de enfermedad intestinal funcional, monitorizar la actividad de la enfermedad, predecir el efecto terapéutico, predecir la recurrencia y pronóstico. El biomarcador ideal es simple, no invasivo, rápido, costo efectivo y reproducible.
1. Proteína C reactiva (PCR)
Es una de las proteínas producida por los hepatocitos durante la reacción de fase aguda, principalmente por estimulación con IL-6, y es un biomarcador sérico usado en varias enfermedades inflamatorias.
Es más sensible en la EC comparada con la CU cuando se evalúa la actividad de la enfermedad. En la EC la presencia de lesiones activas es fuertemente sospechado cuando la PCR es positiva debido a su alta especificidad. Yoon et al. reportaron que la PCR tuvo una sensibilidad del 50.5-53.3% y una especificidad de 85.1-87.2%, siendo que la actividad endoscópica tuvo mejor correlación con PCR que con Velocidad de Sedimentación Globular (VSG) en pacientes con CU. La PCR no tiene la suficiente exactitud para reemplazar a la endoscopia como un biomarcador independiente para curación de la mucosa; sin embargo, predice efecto terapéutico en aquellos pacientes con EC con altos niveles pretratamiento y expuestos a infliximab, la normalización de la PCR a 14 semanas después de la inducción con infliximab incrementa la probabilidad de mantenimiento de la respuesta a remisión a 1 año.
En relación con la CU, los criterios de Oxford establecen que el riesgo de colectomía intrahospitalaria es del 85% si la PCR excede los 45 mg/L o si hay mas de 9 evacuaciones/día en el tercer día de corticoesteroides intravenosos.
2. Calprotectina fecal (CPF)
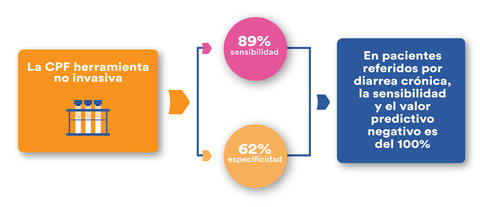
La CPF es una proteína consistente de un complejo de dos proteínas, S100A8 y S100A9. Es principalmente derivada de los neutrófilos y tiene un efecto anti bacterial directo y un rol en la respuesta Inmune innata. Lo que refleja la migración de los granulocitos a través de la pared intestinal en pacientes con EII. La CPF es una de las herramientas no invasivas sensible en distinguir EII de disfunción intestinal, habiéndose reportado tener 89% de sensibilidad y 62% de especificidad en el diagnóstico de enfermedad orgánica; en pacientes referidos por diarrea crónica, la sensibilidad y el valor predictivo negativo es del 100% en la detección de alguna enfermedad colónica orgánica. Un metaanálisis de Menees et al, había <1% de probabilidad de tener EII cuando la PCR era menor <0.5 mg/dL o la CPF <40 mcg/gr. Por otra parte, relacionado a la evaluación de la actividad de la enfermedad y de la actividad clínica, los valores de la CPF han mostrado correlacionar con la actividad histológica y endoscópica.
Los valores de corte de CPF varían entre estudios, en rangos de 30 mcg/gr hasta 274 mcg/gr. Para un valor de corte de 50 mcg/gr, la sensibilidad y especificidad agrupada eran de 92 y 60% respectivamente. Mientras que para un valor de corte de 250 mcg/gr la sensibilidad y especificidad agrupadas fueron de 80 y 82%, respectivamente.
Schoepfer et al. Evaluaron en un estudio prospectivo en pacientes con CU y controles sanos, la correlación entre actividad endoscópica y CPF, PCR, plaquetas, hemoglobina, leucocitos y escalas clínicas. El resultado mostró que la actividad endoscópica de la CU tuvo mejor correlación con CPF.
Relacionado a la predicción de curación mucosa, histológica y respuesta a tratamiento, para CU un valor de corte de 58 mcg/gr detecta curación mucosa. Altos niveles de CPF se asocian con la presencia de neutrófilos en el epitelio y ulceración o erosión en la mucosa intestinal, confirmando la correlación entre CPF y actividad histológica, sin embargo, se requieren estudios prospectivos grandes para identificar los niveles de corte, usando indicadores histológicos validados. Aunado a lo anterior, cada vez existe mayor evidencia para predecir respuesta a tratamiento por CPF; en pacientes con CU en remisión, con niveles elevados de CPF, incrementar la dosis de mesalazina reduce la CPF para aquellos asociados con tasas más bajas de recaída. Los pacientes con reducción significativa de CPF después de dos semanas tras el inicio de inducción con infliximab mostró ser más probable obtener la remisión endoscópica después de 10 semanas. En un estudio prospectivo observacional en pacientes con CU con inicio de bioterapia con infliximab, adalimumab, golimumab o vedolizumab, la CPF evaluada a 8 semanas después del tratamiento con todos los biológicos demostró ser útil en predecir respuesta a curación de la mucosa.
Los niveles basales de CPF pueden predecir no respondedores primarios posterior a la terapia de inducción con infliximab en pacientes con EC, como lo reportó Boschetti et al. Pacientes tratados con infliximab o adalimumab, y niveles de CPF la semana 14, predice remisión clínica a 1 año después de la inducción. La normalización de la CPF dentro de los 12 meses del diagnóstico se asoció con disminución del riesgo de progresión de la EC. De igual manera pacientes con enfermedad de Crohn en manejo con ustekinumab, muestra que la CPF después de 6 semanas podría predecir curación endoscópica posterior la semana 52. Sin embargo, por la complejidad y heterogeneidad de la EII, un solo marcador no puede predecir actividad de la enfermedad en todos los casos. Nuevos biomarcadores han sido explorados y parecen ser prometedores, como microRNAs, N-glicomas plasmáticos, la citocina Oncostatina M, el factor activador de células B y los análisis OMICS (transcriptómicos, genómicos, metabolómicos, lipidómicos y epigenómicos). El uso apropiado de los biomarcadores evita endoscopias frecuentes, reduce la carga física y psicosocial del paciente y puede ayudar a disminuir costos.
3. Estudios de imagen transversal en la EII
Comparada con la CU, la EC es más progresiva y destructiva, desarrollando más de la mitad de los pacientes complicaciones intestinales o extraluminales (estenosis o enfermedad penetrante) dentro de los 10 años posteriores al diagnóstico. Los estudios de imagen transversal incluyen la entero tomografía (EnteroTAC), entero resonancia magnética (EnteroRNM) y el ultrasonido, son exámenes de rutina clave en la evaluación de pacientes con EC. La EC estenosante está asociada con un incremento en la incidencia de complicaciones penetrantes, estas últimas pueden desarrollarse justo por arriba de un sitio de estenosis o directamente dentro de áreas con inflamación intensa. Los abscesos abdominales o pélvicos pueden presentarse de manera espontánea en el 10-30% de los pacientes, como resultado de inflamación transmural y micro perforación del intestino, mientras que el involucro perianal se puede observar en el 50% de los pacientes con EC y representa un fenotipo distinto.
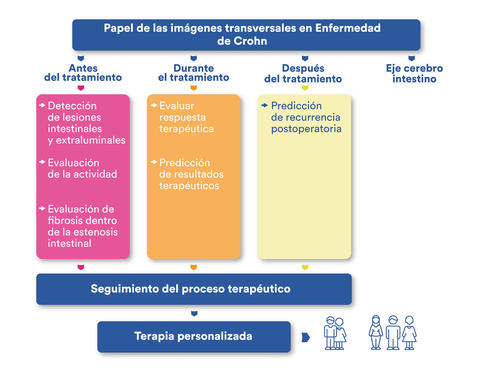
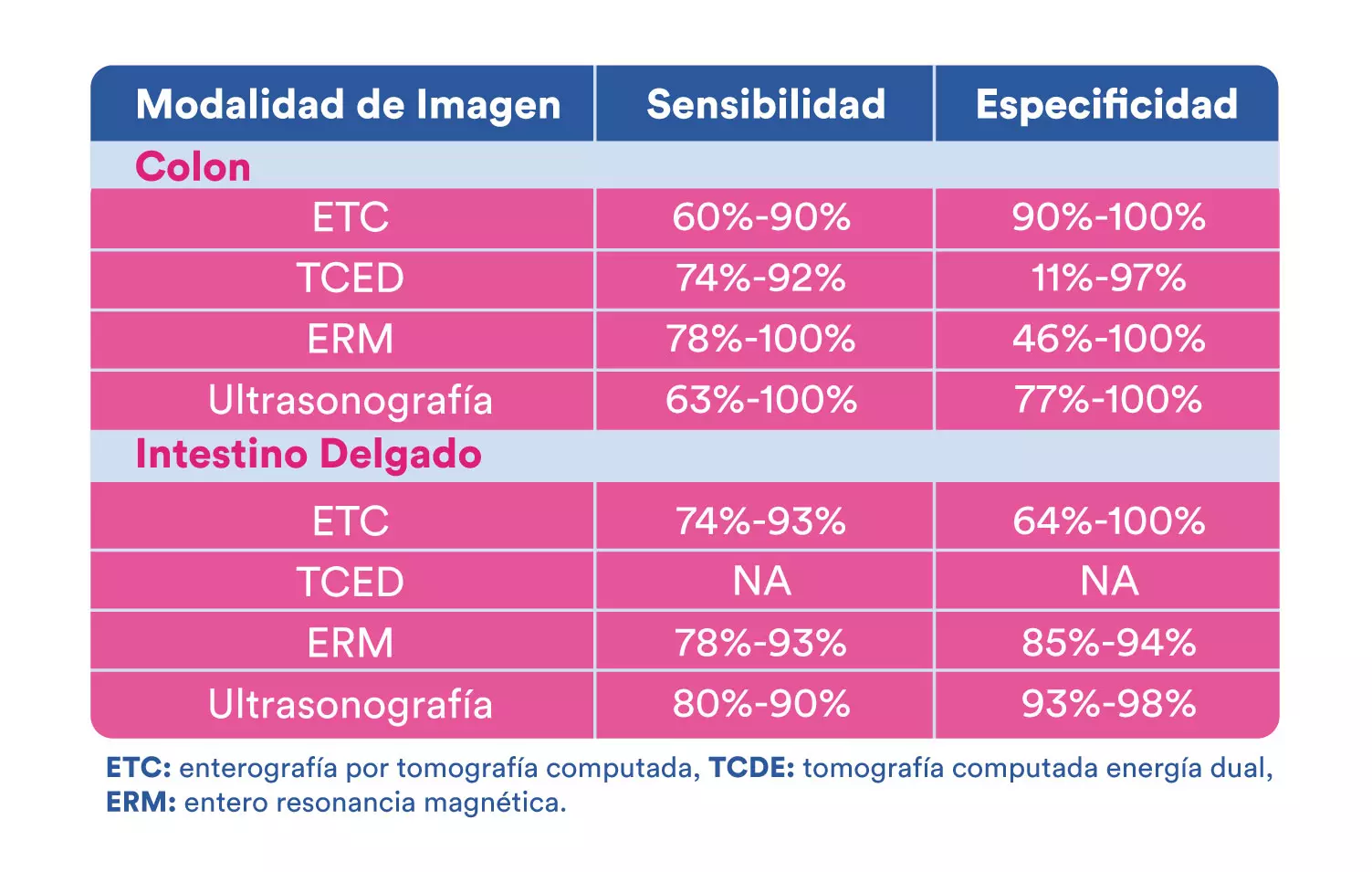
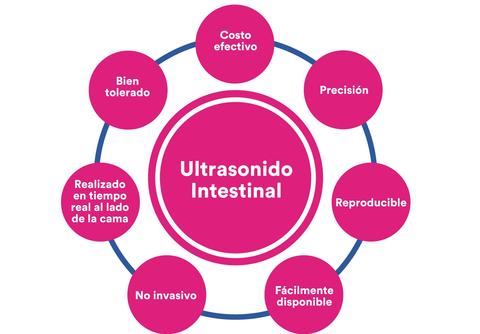
En años recientes el ultrasonido intestinal ha emergido como una herramienta alternativa atractiva para el diagnóstico y seguimiento de pacientes con EC, ya que es reproducible, no invasiva, costo-efectiva y prueba tiempo-eficiente. Ya contando también con evidencia que apoya su utilidad en la CU.
Propiedades únicas del UI que lo convierten en una herramienta estratégica en el manejo de la EII.
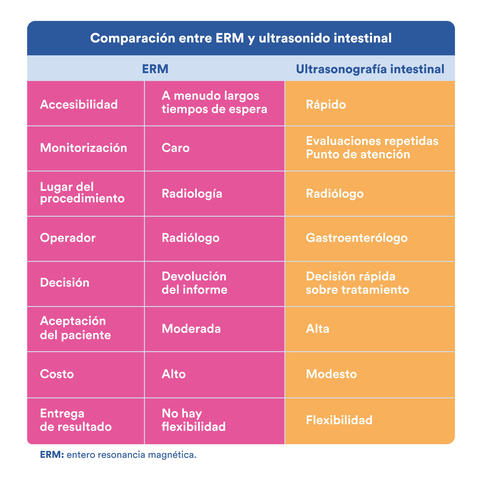
El estudio TRUST&UC (Transabdominal Ultrasonografy of the bowel in Subjets with IBD To monitor disease activity with UC) demostró en las primeras 2 semanas del estudio que el porcentaje de pacientes con un incremento en el grosor de la pared intestinal en el sigmoides o colon descendente, con relación al basal, disminuyó significativamente (89.3-38.6%; 83-42.9%, respectivamente; p<0.01) y se mantuvo bajo la semana 6 y 12 (sigmoides 35.45 y 32%; colon descendente 43.4% y 37.6%; p<0.001.) Presentando la normalización del grosor de la pared intestinal y la respuesta clínica después de 12 semanas de tratamiento, una alta correlación 90.5% de los pacientes con normalización del grosor de la pared intestinal tuvieron respuesta sintomática vs 9.5% sin respuesta sintomática; p< 0.001).
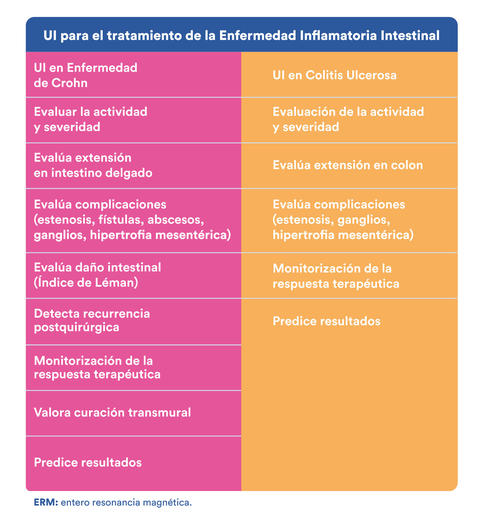
Podemos concluir que existen avances en el diagnóstico, evaluación, seguimiento y respuesta a tratamiento en los pacientes con EII, cuya implementación en la práctica diaria, se espera idealmente, mejoren los desenlaces en este tipo de enfermedades.
1. Wagatsuma, K., Yokoyama, Y., & Nakase, H. (2021). Role of biomarkers in the diagnosis and treatment of inflammatory bowel disease. Life, 11(12), 1375.
2. Dragoni, G., Innocenti, T., & Galli, A. (2021). Biomarkers of inflammation in inflammatory bowel disease: how long before abandoning single-marker approaches?. Digestive Diseases, 39(3), 190-203.
3. Rodrigues, B. L., Mazzaro, M. C., Nagasako, C. K., Ayrizono, M. D. L. S., Fagundes, J. J., & Leal, R. F. (2020). Assessment of disease activity in inflammatory bowel diseases: Non-invasive biomarkers and endoscopic scores. World Journal of Gastrointestinal Endoscopy, 12(12), 504.
4. Bartlett, D. J., Ramos, G. P., Fletcher, J. G., & Bruining, D. H. (2022). Imaging Evaluation of Inflammatory Bowel Disease Complications. Gastrointestinal Endoscopy Clinics, 32(4), 651-673.
5. Wang, Y. D., Zhang, R. N., Mao, R., & Li, X. H. (2022). Inflammatory bowel disease cross-sectional imaging: What's new?. United European Gastroenterology Journal.
6. Shivaji, U. N., Segal, J. P., Plumb, A. A., Quraishi, M. N., Ghosh, S., & Iacucci, M. (2022). Intestinal ultrasonography: a useful skill for efficient, non-invasive monitoring of patients with IBD using a clinic-based point-of-care approach. Frontline Gastroenterology, 13(5), 447-451.
7. Allocca, M., Furfaro, F., Fiorino, G., Peyrin-Biroulet, L., & Danese, S. (2021). Point-of-care ultrasound in inflammatory bowel disease. Journal of Crohn's and Colitis, 15(1), 143-151.
8.- Noriega-Álvarez, E., & Martín-Comín, J. (2023, January). Molecular imaging in inflammatory bowel disease. In Seminars in Nuclear Medicine. WB Saunders.
9. Maaser, C., Petersen, F., Helwig, U., Fischer, I., Roessler, A., Rath, S., ... & Kucharzik, T. (2020). Intestinal ultrasound for monitoring therapeutic response in patients with ulcerative colitis: results from the TRUST&UC study. Gut, 69(9), 1629-1636.